
- 首页
- 关于我们
-
服务介绍
我们的服务
品质赋能平台 聚力价值信任-
聚烯烃类
-
矿石分析
-
金属材料及制品分析
-
金属加工油
-
工业清洗剂
-
水处理剂分析
-
纺织制造用剂
-
建筑助剂
-
食品添加剂分析
-
化妆品分析
-
消毒剂/抗(抑)菌制剂
-
工程塑料
-
橡胶助剂
-
节能环保助剂
-
玩具道具
-
木材及玻璃助剂
-
选矿助剂
-
油田助剂
-
表面活性剂
-
印刷化学品
-
电子化学品
-
食品/保健品食品
-
中药
-
除草剂
-
杀虫剂
-
PVC
-
兽药
-
肥料
-
细胞组织试剂
-
诊断试剂
-
前处理剂
-
后整理剂
-
染色助剂
-
印花助剂
-
皮革助剂
-
石材助剂
-
其它建筑材料
-
污水处理剂
-
工业循环水处理剂
-
塑料助剂/母粒
-
橡胶
-
水产药剂
-
工业用油脂
-
车船用油脂
-
燃料用油
-
新型油品添加剂
-
切削液
-
金属加工液
-
商用清洗剂
-
民用清洗剂
-
电镀药水/添加剂
-
化学镀添加剂
-
磷化液
-
钝化液
-
净化吸附类产品
-
烟草及电子烟
-
胶黏剂
-
油漆涂料
-
油墨
-
中药材
-
食品
-
饲料
-
阻垢剂
-
除垢剂
-
絮凝剂
-
反渗透药剂
-
精细助剂
-
产品毒性/安全性测试
-
测试
-
电子化学品行业
-
高纯电子级化学品
-
功能性电子化学品
-
超纯水
-
食品热点测试项目
-
- 动态资讯
- 联系我们


在线咨询

联系电话
400-182-9001
置顶

—— 药包材相容性 ——

药品的质量不仅与药品本身有关,其所用材料与药品发生相互作用后,也会导致药品的有效性和稳定性发生改变,进而危害患者生命健康。 国家食品药品监督管理总局要求药品生产企业及医药包装材料生产企业必须对药品和包装材料的相容性进行研究,确保药物质量。凡不符合的,必须立即停止使用该药用包装,并重新开展规范的研究,严防选用不恰当药用包装材料造成药品质量问题。

—— 研究对象 ——
可提取与浸出物研究
包材
安瓿瓶、西林瓶、卡式瓶、
预灌装、聚酯瓶、丁基胶塞等
制剂
吸入气雾剂、注射液、冻干粉、滴眼剂、
透皮贴剂、口服溶液、口服胶囊等
一次性使用系统
硅胶管、滤芯、滤膜等

—— 研究流程 ——
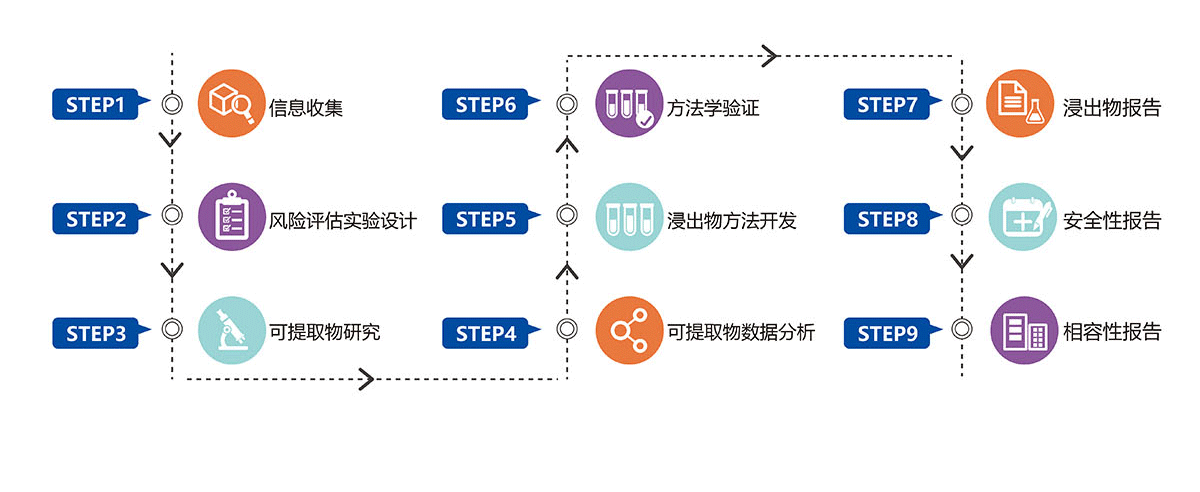
—— 药包材&生产工艺系统相容性研究 ——

1、信息的收集评估
服务项目:根据项目申请单的包装材料配方信息、生产工艺信息以及与药品有关的关键参数(如规格、给药途径、日最大摄入量等)为客户定制研究方案。
主要依据:《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则(试行)》、《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》、《化学药品注射剂与药用弹性体相容性研究技术指导原则(征求意见稿)》、《YBB00142002-2015药品包装材料与药物相容性试验指导原则》等
2、可提取物研究
模拟、提取试验会充分考虑药品在生产、贮存、运输以及使用过程中可能面临的极端条件进行阈值的计算、模拟液和模拟条件的选择、以及对可提取物方法,帮助客户筛选包材,完成可提取物研究、协助客户申报。
主要依据:USP<1665> 、USP<665>、USP<1663>、ICH指导原则、PQRI指导原则、EMEA指导原则、《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》、《化学药品注射剂与药用弹性体相容性研究技术指导原则(试行)》、《药品包装材料与药物相容性试验指导原则》


3、方法学设计与验证
依据中国药典、USP以及国内外相关指导原则,对测试方法进行方法学验证,验证项目包括但不限于专属性、线性、准确度、精密度(中间精密度和重复性)、定量限和范围。
4、浸出物(迁移)试验
服务项目:针对加速、长期稳定性样品的测试,根据CFDA药品研发试验记录规定规范原始数据管理。
主要依据:USP<1665> 、USP<665>、USP<1663>、USP<1664>、ICH指导原则、PQRI指导原则、EMEA指导原则、《化学药品注射剂与塑料包装材料相容性研究技术指导原则(试行)》、《化学药品注射剂与药用弹性体相容性研究技术指导原则(试行)》、《药品包装材料与药物相容性试验指导原则》


5、毒理学安全性评估
参考毒理学数据库如DEREK, TOXNET, HSDB, TOXLINE等,由毒理学专家完成包括建模、数据库查询、文献查询、阈值计算等工作,从而得到完整的毒理学评估报告。
主要依据: FDA、CFDA、ICH、欧洲药品局(EMA)、致癌性数据库(CPDB)、美国毒物和疾病管理中心(ATSDR)数据库、美国环境保护署(EPA)
6、结论
由提取和迁移试验,并参考毒理学评估结果,
给予客户最后的相容性结论。


—— 英格尔优势 ——
01
方案完整:
根据国内外指导原则,以及申报国家法规出具详细方案后执行。
02
知名CRO团队:
负责老师均来自于药学相关专业,丰富的项目经验。
03
合规实验室:
满足ISO 17025要求,参照GMP执行研究方案。
04
数据完整、可溯源:
OPEN LAB网络版审计追踪,异地NAS备份,保证数据的完整、可追溯。
05
效率快、周期短:
项目启动即确定相应报告发送节点,不延误项目申报。
06
项目合作企业已超100家:
项目合作企业已超100家,得到客户及审核单位的认可。

—— 资质 ——



