
- 首页
- 关于我们
-
服务介绍
我们的服务
品质赋能平台 聚力价值信任-
聚烯烃类
-
矿石分析
-
金属材料及制品分析
-
金属加工油
-
工业清洗剂
-
水处理剂分析
-
纺织制造用剂
-
建筑助剂
-
食品添加剂分析
-
化妆品分析
-
消毒剂/抗(抑)菌制剂
-
工程塑料
-
橡胶助剂
-
节能环保助剂
-
玩具道具
-
木材及玻璃助剂
-
选矿助剂
-
油田助剂
-
表面活性剂
-
印刷化学品
-
电子化学品
-
食品/保健品食品
-
中药
-
除草剂
-
杀虫剂
-
PVC
-
兽药
-
肥料
-
细胞组织试剂
-
诊断试剂
-
前处理剂
-
后整理剂
-
染色助剂
-
印花助剂
-
皮革助剂
-
石材助剂
-
其它建筑材料
-
污水处理剂
-
工业循环水处理剂
-
塑料助剂/母粒
-
橡胶
-
水产药剂
-
工业用油脂
-
车船用油脂
-
燃料用油
-
新型油品添加剂
-
切削液
-
金属加工液
-
商用清洗剂
-
民用清洗剂
-
电镀药水/添加剂
-
化学镀添加剂
-
磷化液
-
钝化液
-
净化吸附类产品
-
烟草及电子烟
-
胶黏剂
-
油漆涂料
-
油墨
-
中药材
-
食品
-
饲料
-
阻垢剂
-
除垢剂
-
絮凝剂
-
反渗透药剂
-
精细助剂
-
产品毒性/安全性测试
-
测试
-
电子化学品行业
-
高纯电子级化学品
-
功能性电子化学品
-
超纯水
-
食品热点测试项目
-
- 动态资讯
- 联系我们


在线咨询

联系电话
400-182-9001
置顶
美国医疗器械上市前系列—510(k)递交类别概述
来源: 发布时间:2022-09-02
510(k)申报是FDA的CDRH(器械和放射健康中心)部门占比最大的上市前递交方式,更是中国制造商出口美国最为关注的形式,本篇文章就来简析510(k)的所有递交类别以及对应的要求和适用条件。

首先,我们先明确一下所有510(k)递交的异同点;
所有的510(k)都:1)都需要识别出至少一个对比器械;2)所有的510(k)递交都需要包含论证与对比器械实质性等同的内容;
不同类别的510(k):1)具有不同的官方审核周期;2)不同的行政评审标准和内容;3)递交的技术文件内容会随递交类别而有所不同(需要测试概述&需要完整测试报告)
接下来我们就总共5种510(k)申报类别进行具体分析,先看一张简单的归纳总结表:
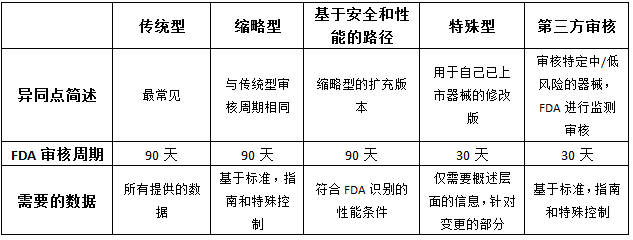
每种方式的具体特点以及适用情形的介绍如下:
(1)传统型510(k)
传统型是最普遍且常见的510(k)申报形式,选定一款符合要求的对比器械并准备相关资料证明与其的实质等同性,需要注意的是,传统型510(k)中所有的测试报告需要提供完整版本,包括所有的测试数据。
优点:传统型510(k)适用于所有符合条件的申报情形,在国内的应用范围最广;
局限:在某些特定情形下,选择传统型申报会拉长审核周期以及审核难度。
(2)缩略型510(k)
相比传统型510(k),缩略型最重要的适用条件就是申报的器械具有专门的FDA指导原则,或者符合特殊控制的要求,或者依赖于符合性的标准。
优点:缩略型510(k)不需要提供完整的测试报告,只需要提供报告的概述。
局限:仅适用于特定的医疗器械类别。
(3)基于安全和性能路径
该类申报为缩略型510(k)的扩充形式,适用于特定风险可控的器械,在这个路径下,申报器械需要和对比器械拥有相同的预期用途以及相同的技术性能(不会引起不同的安全有效性的问题);一般来说,该路径下FDA不会审核具体测试数据。
目前适用于基于安全和性能路径的器械类型:
脊柱骨板系统
非脊柱的矫正金属键骨钉和垫圈
用于记录的皮肤电极器械
传统Foley导管
手术缝合线
树脂义齿基托
空心螺钉系统
(4)特殊型510(k)
特殊型510(k)最为重要的一个特征就是必须是针对制造商已经拿到K号的产品的变更(说明书、标签或者技术)的变更而进行的申报。特殊型申报下对于性能数据的要求有三种可能:a)不需要提供数据b)用普适的方法来评估变更c)用概述或者风险分析的形式提供。
优点:特殊型510(k)申报是最快速的一种510(k),官方审核周期为30天;并且特殊型申报也不要求提供完整的测试数据。
局限:仅仅适用企业自身以获得510(k)产品变更的申报。
(5)第三方审核
该类申报方式是FDA为了提高审核的效率,将更多的精力放在中高风险器械的评审上而建立的一种申报方式;FDA授权指定有资质的第三方全权审核特定的中低风险的医疗器械产品;该申报包含了传统型,缩略型和特殊性申报;在审核中FDA会进行30天的监督审核来确保评审的有效性。
下图为目前FDA认证具有审核510(k)资质的第三方:

结语:目前中国制造商进行的510(k)主要还是传统型申报,对其他的方式不够了解也不敢轻易尝试;但是根据产品的特点选择合适的申报方式不仅会减轻技术文件的工作量,节约成本,而且还会缩短申报周期和审核难度,所以建议大家多了解不同的510(k)申报方式的内容和适用对象;当然,英格尔的咨询师可以帮助制造商量身制定最佳产品申报策略和最合适的申报方式,帮助企业快速高效地完成美国市场准入。


