
- 首页
- 关于我们
-
服务介绍
我们的服务
品质赋能平台 聚力价值信任-
聚烯烃类
-
矿石分析
-
金属材料及制品分析
-
金属加工油
-
工业清洗剂
-
水处理剂分析
-
纺织制造用剂
-
建筑助剂
-
食品添加剂分析
-
化妆品分析
-
消毒剂/抗(抑)菌制剂
-
工程塑料
-
橡胶助剂
-
节能环保助剂
-
玩具道具
-
木材及玻璃助剂
-
选矿助剂
-
油田助剂
-
表面活性剂
-
印刷化学品
-
电子化学品
-
食品/保健品食品
-
中药
-
除草剂
-
杀虫剂
-
PVC
-
兽药
-
肥料
-
细胞组织试剂
-
诊断试剂
-
前处理剂
-
后整理剂
-
染色助剂
-
印花助剂
-
皮革助剂
-
石材助剂
-
其它建筑材料
-
污水处理剂
-
工业循环水处理剂
-
塑料助剂/母粒
-
橡胶
-
水产药剂
-
工业用油脂
-
车船用油脂
-
燃料用油
-
新型油品添加剂
-
切削液
-
金属加工液
-
商用清洗剂
-
民用清洗剂
-
电镀药水/添加剂
-
化学镀添加剂
-
磷化液
-
钝化液
-
净化吸附类产品
-
烟草及电子烟
-
胶黏剂
-
油漆涂料
-
油墨
-
中药材
-
食品
-
饲料
-
阻垢剂
-
除垢剂
-
絮凝剂
-
反渗透药剂
-
精细助剂
-
产品毒性/安全性测试
-
测试
-
电子化学品行业
-
高纯电子级化学品
-
功能性电子化学品
-
超纯水
-
食品热点测试项目
-
- 动态资讯
- 联系我们


在线咨询

联系电话
400-182-9001
置顶
美国医疗器械上市前系列—Q-Submission介绍
来源: 发布时间:2022-09-15
我们在咨询服务的过程中经常会听到进军美国市场的客户的这些问题:
产品要不要做临床?如果要做,是否需要在美国做?样本量?流程上的要求?
国内做的动物实验报告,FDA是否接受?
产品找不到对比器械,怎么申报?
创新产品怎么在FDA申报?
......
这些问题随着中国医疗器械行业的蓬勃发展,科技创新能力的提升而不断涌现出来,除了在申报前的咨询,我们也遇到了很多客户在510(k)申报的AI发补阶段问题严重并难以补救的情况;这些问题都是可以在项目初期或者发补初期与FDA进行沟通并获得有效的反馈,所以今天就要详细地介绍在产品申报过程中与FDA进行合规沟通的重要方式,Q-Submission。
什么是Q-Submission?
Q-Submission,简称Q-Sub,是在医疗器械的申报中与FDA不同形式沟通的一种机制;通俗地说,Q-Submission就是医疗器械厂商在申报特定产品的过程中(包括申报前和申报中)遇到特定问题希望与FDA进行沟通并得到有效反馈的一种沟通方式。
Q-submission的种类、申报准备以及审核流程
Q-submission包括了很多种形式,几乎囊括了所有医疗器械申报中可以与FDA进行沟通的方式(见下表):
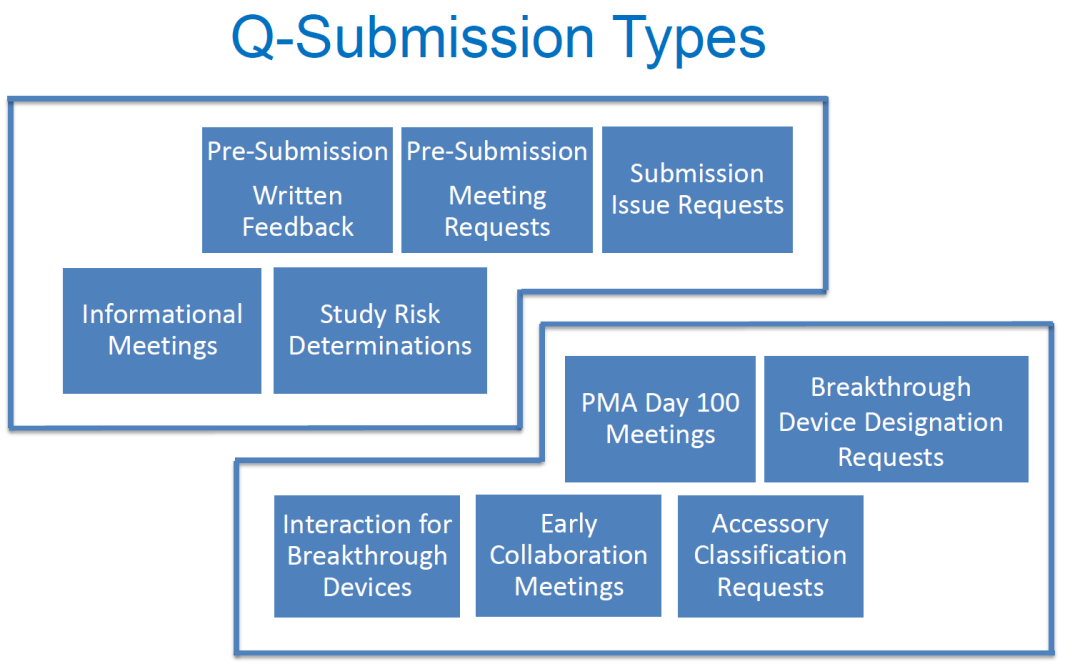
本次着重会讨论两种对中国厂商最常用也是最重要的Q-sub,预提交(Pre-Submission)和递交问题申请(Submission Issue Requests)。
1. 预提交(Pre-Submission)
预提交(下文称为Pre-Sub),是医疗器械申报者就将来需要递交的器械申报(比如510(k)、IDE、PMA等)的问题与FDA进行沟通从而获得FDA反馈的一种沟通方式,Pre-sub是最常见的Q-submission种类。
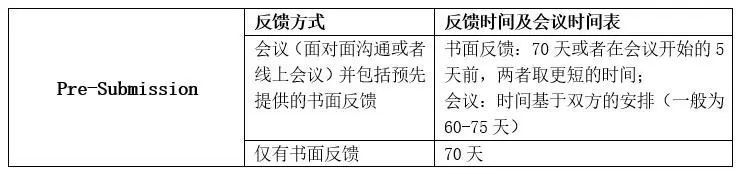
Pre-sub反馈方式&时间表
1.1 Pre-Sub申报准备
Pre-Sub递交中主要包含的就是申报者未来递交的器械信息以及具体的问题,包括:
未来器械的申报类型
器械背景描述(器械描述,相关文献,相关方案)
具体的问题(有关申报中的具体问题描述,可以包含制造商的观点)
实验方案(性能测试,动物实验或者临床的方案描述)
实验数据(包含上述三种实验的原始数据供FDA审核)
申报策略和路径
1.2 Pre-Sub审核流程
行政审核
行政审核将在FDA收到Pre-Sub资料的15天内完成,主要审核该递交资料是否符合FDA的法规要求以及内容是否具体完整;通过后审核会正常进行;若FDA判定Pre-Sub申报资料不符合要求,会进入RTA状态,告知申请者审核的缺陷项,企业需要补充相应的资料完善递交文件;待企业整改完成后,FDA会重新进行审核,并在15天内做出审核判定。
预约会议
FDA会根据申请者在Pre-Sub中提供的日期中选择一个合适的安排会议,一般都在FDA收到Pre-Sub技术文件的65-70天。
书面回复
书面回复一般都是在审核周期的70天内完成;若申请人要求的回复方式包含会议和书面回复,那书面回复会在会议开始的5天前给到申请者。
2. 递交问题申请(Submission Issue Requests)
递交问题申请(下文简称SIR),是医疗器械申报者就产品申报过程中的发补(510(k)的AI发补,De Novo的发补,IDE发补)问题与FDA沟通并获得反馈的一种沟通方式。
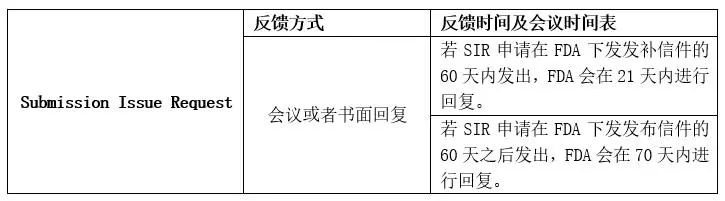
SIR反馈方式&时间表
2.1 SIR申报准备
SIR递交中主要包含的是申报者基于FDA在审核发补中(Hold Letter)的发现项而提出的相关问题的内容,包括:
具体的问题,这些问题都需要与审核发现项相关且清晰明确
偏好的反馈形式,申报者可以选择书面回复或者会议的反馈形式
2.2 SIR审核流程
SIR审核中没有行政审核的部分
反馈
FDA在收到SIR后会根据申报者的选择提供相应的反馈方式,包括书面回复或者是会议。回复的周期主要有两种情况:
情况A:在资源允许的情况下,如果SIR的发出是在申报者收到发补信件(Hold Letter)的60天内,FDA会在收到SIR的21天内给出反馈;
情况B:在资源允许的情况下,如果SIR的发出是在申报者收到发布信件(Hold Letter)的60天以外,FDA会在收到SIR的70天内给出反馈。
几点总结
1、对于有以下情形的医疗器械厂商,我们建议在正式进行产品申报前进行Pre-Sub的递交:
产品分类已经明确,但未找到合适的已在美国上市的对比器械
产品涉及到动物实验或者临床实验;
产品为创新型产品,或者使用了创新型的材料;
所有的三类需要做PMA的产品。
2、SIM可以是企业在AI发补中一筹莫展或者有无法解决的发现项时的救命稻草,企业在收到发补后需要第一时间决定是否需要进行SIM(在60天内),尽可能缩短SIM的周期;
3、无论是Pre-Sub还是SIM,都不是没有逻辑性地堆叠问题发给FDA,需要在合规的基础上有技巧地发问,这样才能最大程度地获得FDA有质量的反馈,从而解决企业面临的申报问题。


